Das ABC der Düngung - Teil 2: pH-Wert
Im ersten Teil der Serie lag der Fokus auf den Grundlagen der Düngung und mit welchen Problemen dieser wichtige Bereich der Landwirtschaft zu kämpfen hat. Nun steigen wir tiefer in die Materie ein und gehen der Frage nach, was es mit dem pH-Wert auf sich hat und warum dieser für die Düngung bedeutend ist.
Erste Definitionen
"Der pH-Wert ist der negativ dekadische Logarithmus der Wasserstoff-Ionen-Konzentration“. Dies ist zwar die offizielle Definition, jedoch für Nicht-Experten kaum verständlich. Gehen wir darauf etwas näher ein und versuchen das aufzuklären.
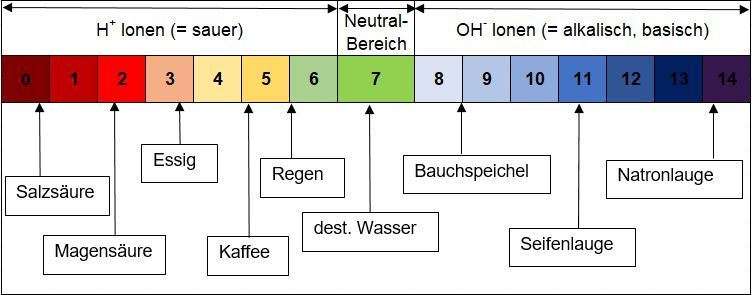
pH = potentia hydrogenium (lat.), was nichts anderes heißt als die Kraft des Wasserstoffs. Sprechen wir von Konzentrationen geht es meistens um Verhältnisse, welche anhand folgender Grafik erläutert werden:
pH = potentia hydrogenium (lat.), was nichts anderes heißt als die Kraft des Wasserstoffs. Sprechen wir von Konzentrationen geht es meistens um Verhältnisse, welche anhand folgender Grafik erläutert werden:
Der pH-Wert stellt das Verhältnis der sauren Wasserstoffionen (H+) zu den alkalischen Hydroxidionen (OH-) dar. Er gibt somit Auskunft über den Säure- und Basengehalt.
Ein Beispiel: Nimmt der pH-Wert des Bodens ab, spricht man von der sogenannten Bodenversauerung. Dabei wird der Anteil an sauren H+ immer mehr und es können in weiterer Folge keine anderen Nährstoffionen mehr aufgenommen werden. Das Gleichgewicht verschiebt sich.
Abschließend ist noch zu klären warum die Bezeichnung dekadisch erfolgt (bezieht sich auf die Zahl 10):
dh. pH-Wert 4 ist…
Ein Beispiel: Nimmt der pH-Wert des Bodens ab, spricht man von der sogenannten Bodenversauerung. Dabei wird der Anteil an sauren H+ immer mehr und es können in weiterer Folge keine anderen Nährstoffionen mehr aufgenommen werden. Das Gleichgewicht verschiebt sich.
Abschließend ist noch zu klären warum die Bezeichnung dekadisch erfolgt (bezieht sich auf die Zahl 10):
dh. pH-Wert 4 ist…
- 10 mal saurer als pH 5,
- 100 mal saurer als pH 6 und
- 1.000 mal saurer als pH 7!
pH-Wert ist für die Ausnutzung der Nährstoffe entscheidend!
Vor allem deswegen, weil verschiedene Nährstoffe unterschiedliche pH-Werte voraussetzen, um den Pflanzen optimal zur Verfügung zu stehen.
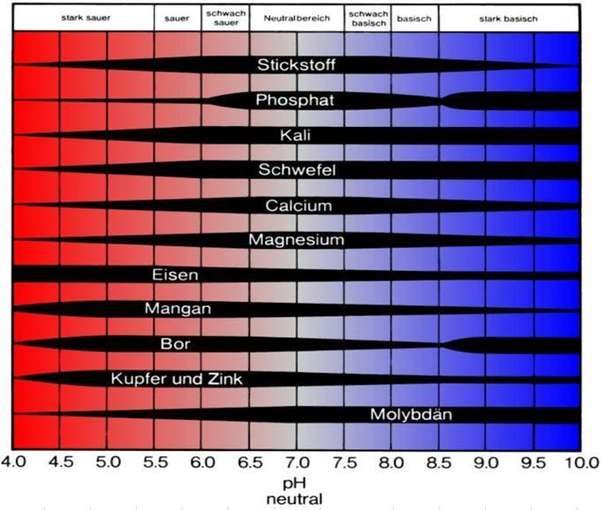
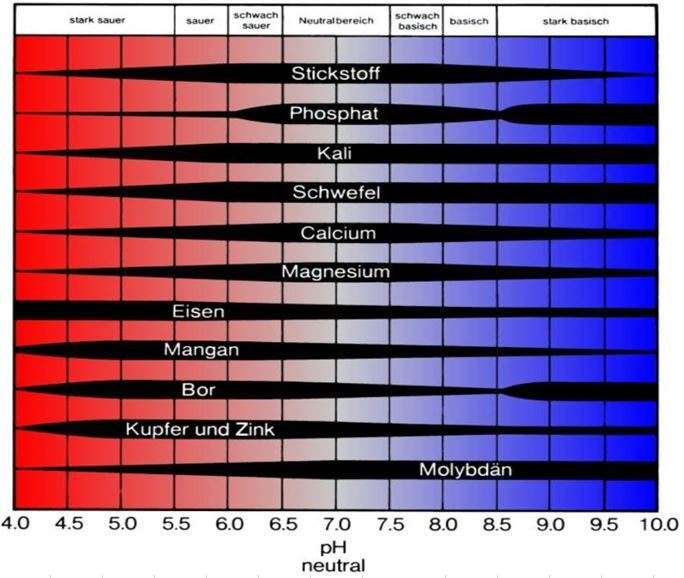
In folgender Grafik wird das verdeutlicht:
Mit sinkendem pH-Wert sinkt auch die Verfügbarkeit der Hauptnährstoffe (die Stickstoffausnutzung sinkt unter pH 5,5 in etwa um die Hälfte). Spurenelemente sind eher im leicht sauren Bereich besser verfügbar – mit Ausnahme von Molybdän.
Grundsätzlich sind alle Nährstoffe bis pH 7 für Pflanzen weitgehend verfügbar.
Achtung! Bei sehr niedrigen pH-Werten (unter 4) kommt es zur verstärkten Auswaschung von Eisenverbindungen und Aluminium. Zu hohe Konzentrationen wirken auf Pflanzen toxisch!
Aus diesem Grund empfiehlt es sich die Bodenversauerung laufend zu kontrollieren. Dies kann entweder mit pH-Schnelltests oder mittels exakter Bodenuntersuchung im Labor durchgeführt werden.
Grundsätzlich sind alle Nährstoffe bis pH 7 für Pflanzen weitgehend verfügbar.
Achtung! Bei sehr niedrigen pH-Werten (unter 4) kommt es zur verstärkten Auswaschung von Eisenverbindungen und Aluminium. Zu hohe Konzentrationen wirken auf Pflanzen toxisch!
Aus diesem Grund empfiehlt es sich die Bodenversauerung laufend zu kontrollieren. Dies kann entweder mit pH-Schnelltests oder mittels exakter Bodenuntersuchung im Labor durchgeführt werden.
Fazit:
- pH-Wert ist ein zentraler Parameter und hat für vielerlei Vorgänge im Boden eine große Bedeutung
- optimale Nährstoffverfügbarkeiten für Pflanzen bei unterschiedlichen pH-Werten beachten
- keine Scheu vor Bodenchemie - klingt komplex, ist aber relativ einfach
- Schnelltests nutzen und Bodenuntersuchungen durchführen
Wie der Bodenversauerung entgegenzuwirken ist und welche Rolle hierfür der Kalk spielt, klären wir im Teil 3 der Artikelserie.